Biostatistics
About Service
DreamCIS의 통계팀은 임상시험을 올바르게 수행하고, 목표한 결과가 도출될 수 있도록 높은 수준의 SOP를 보유하고 있으며, 담당하는 모든 업무를 ICH Guideline 및 의약품 임상시험 관리기준에 부합하게 수행하여 임상시험의 가치를 향상시키고자 끊임없이 노력하고 있습니다.
DreamCIS의 통계 전문가들은 풍부한 실무경험을 통해 축적된 Know-How를 활용하여, 효율적인 업무 프로세스에 따라 임상시험 통계분석결과를 제공하고 있습니다.
또한, 합리적이고 전문적인 서비스를 제공하기 위하여 체계화된 교육 훈련 프로그램을 통해 업무에 필요한 전문 지식과 기술을 습득하고 이를 다시 업무 프로세스에 반영하는 선 순환 구조를 구축하고 있습니다.
Service Scope
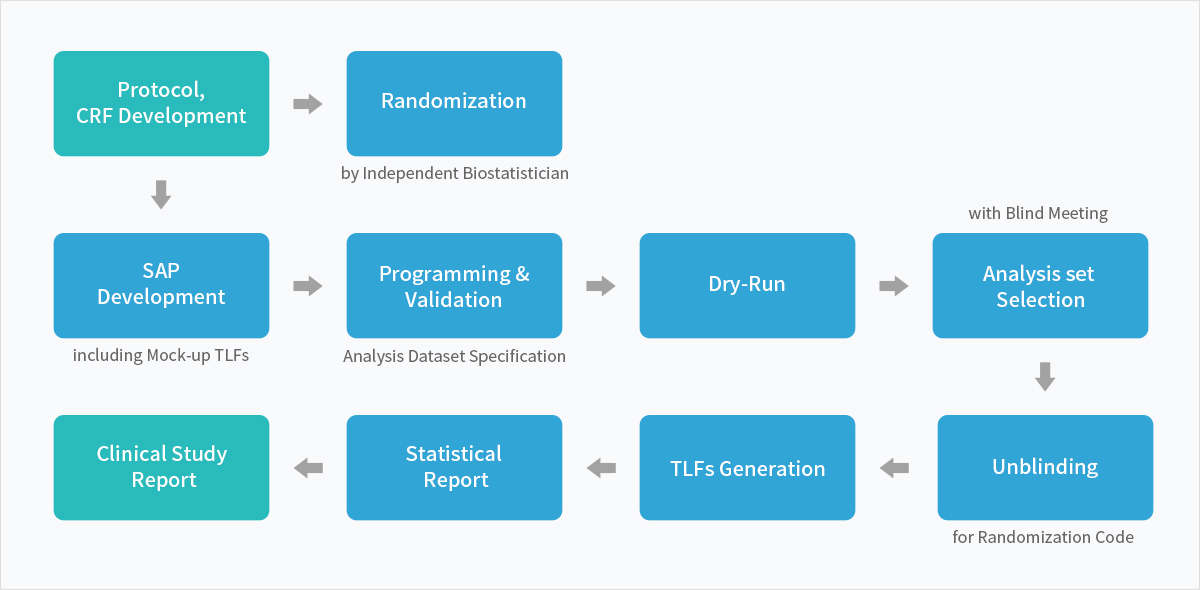
Service Process
Data Management
About Service
DreamCIS의 Data Management Team는 고품질의 임상시험 자료의 수집과 관리를 위하여 전문화된 SOP를 보유하고 있으며, ICH Guideline, 21 CFR Part11, GCDMP 및 의약품 임상시험 관리기준을 준수함으로써 전문적이고 신뢰할 수 있는 Data Management 서비스를 제공하고 있습니다.
Data Management Team는 각 직무별 특화된 Clinical Data Project Leader(CDPL), Clinical Data Associate(CDA), Clinical Data Programmer(CDP), Data Entry Coordinator(DEC) 등의 전문가를 구성하여 CRF 개발에서부터 CDMS setup & operation, Lock까지 Full Scope의 Data Management 서비스를 제공하고 있으며, Phase I~III, Late Phase 및 Observational Study 등의 풍부한 업무 경험 및 전문 지식을 바탕으로 신속하고 정확한 임상시험 자료 처리 서비스를 제공합니다.
Global Standard를 따르는 Oracle Clinical 4.5.3, Remote Data Capture 4.5.3를 2009년도에 도입하였고 이와 함께 축적된 임상시험 Data Management 기술력을 기반으로 2012년도에 자체 개발한 EDC인 DreamTrial을 통해 업무를 수행하고 있으며, 2015년부터 Medidata의 RAVE를 도입하여 다양한 CDMS 서비스를 제공하고 있습니다.
Service Scope
CDMS Clinical Data Management System(CDMS : RAVE / DreamTrial / Oracle Clinical 4.5.3)
Project Management
About Service
DreamCIS는 각각의 프로젝트마다 하나의 연락 창구로 Project manager가 역할을 하고 있습니다.
Single contact point의 DCIS PM은 Clinical development 서비스에 대한 전문 지식, 서비스 전문성 및 책임성을 기반으로 임상이 성공적 진행을 위해 과거 경험에서 얻은 지식을 적용하여 일정 및 위험을 사전에 관리합니다.
DreamCIS 의 PM팀은 고객의 목표를 위해 함께 고민하고 최적의 결과물을 전달드릴 것을 약속 드립니다.
PM팀의 경험과 지식을 통하여 성공적인 프로젝트의 결과물을 위해 약속된 시간과 예산에 맞춰 전달 드릴 수 있음을 약속 드립니다.
Service Scope
Project Plan
Project Communication Plan
Documents created at start of and maintained throughout the study
Pharmacovigilance
About Service
DreamCIS 의 Pharmacovigilance 팀은 임상 시험 및 시판 후 Pharmacovigilance의 서비스에 숙련 된 전문 PV team이 약물 감시 규제를 기반으로 업무를 제공하고 있습니다.
더 복잡한 규제(표준)에 대응할 수 있도록 특정 프로젝트의 요구 사항에 맞게 맞춤형 서비스에 이르기까지 다양한 업무를 제공하고 있습니다.
풍부한 의학적 지식 및 규제기관과의 업무 경험과, 지속적인 교육을 통하여 끊임없이 변화하는 안전성정보, 각종 규제, 개발 환경에서 최고 수준의 약물 안전성을 유지할 수 있도록 업무를 지원합니다.
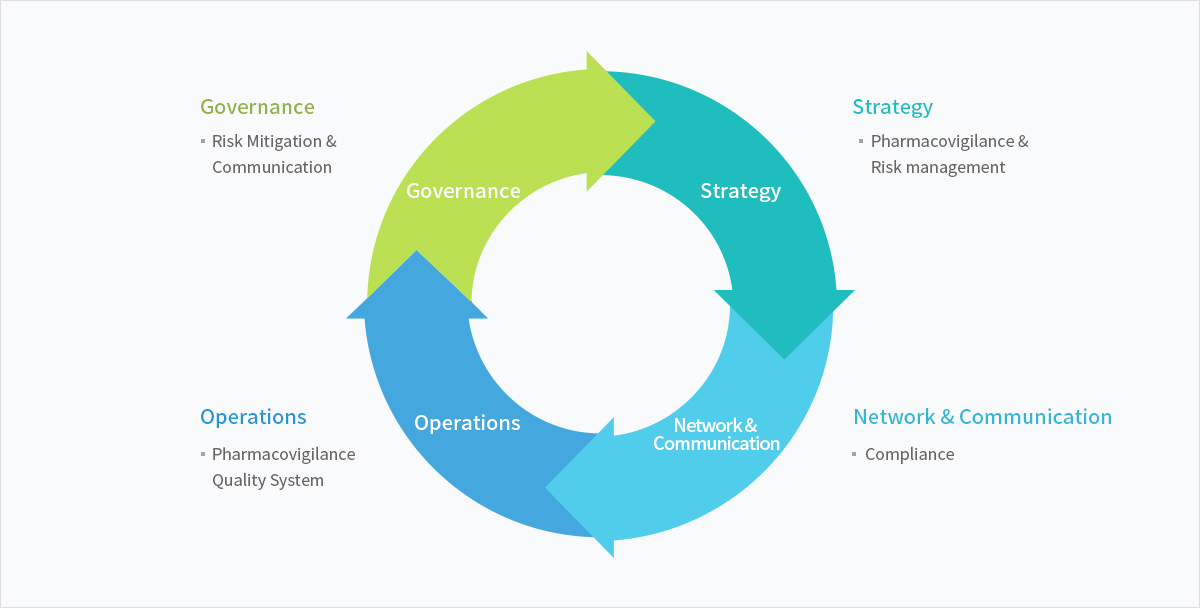
Service Scope
Medical Writing
About Service
Medical writing 은 Clinical development 또는 의료기기의 임상에 성공 또는 실패에 중요한 역할을 합니다.
규제 기관은 오류 및 부정확성과 정확한 문서화 및 보고가 필요한지 여부에 대하여 집중적으로 조사합니다.
이 단계에서의 지연은 clinical development에서 더 나아가 제약/의료기기사의 revenue에 직접적인 영향을 가져다 줍니다.
DreamCIS 의 Medical Writing 팀은 제품 개발 노력을 뒷받침하는 데 필요한 광범위한 의학 및 과학적 문서를 편집, 구성, 작성 및 제작할 수 있는 전문적 인력을(자격을) 갖추고 있습니다.
DreamCIS는 모든 프로젝트에 (Phase I~IV, PMS ,Observational study) 대하여 신속한 처리 및 유연하고 효율적인 프로세스를 제공 할 것을 약속합니다.
Service Scope

Site Start Up
About Service
다양한 임상연구, PMS 및 Study를 통해 확보된 기관별 IRB 정보 및 작성시 주의사항, 제출문서, 특성 등에 대해 Site Management System을 구축하여 관리되고 있어 신속하고 효율적인 서비스 제공이 가능합니다. 또한 다양한 분야의 숙련된 경력자들로 구성되어 있어 축적된 Know-How를 활용하여 문제해결이 가능하며, 고객사에게 고품질의 Start-Up 서비스를 제공하며 계획된 일정으로 업무를 진행해 드리고 있습니다.
CR SSU
임상시험에서 연구자 선정부터 임상시험 개시 전까지의 업무를 진행하고 있으며, 계획된 일정 내에 개시 전까지의 업무를 진행해 드리고 있습니다.
LPS SSU
DreamCIS LPS Study Start-Up 팀은 장기간&다기관으로 진행되는 PMS 및 NIS/OS study의 특성에 맞춰 IRB Affairs 및 Site Contract 업무를 전담하고 있습니다.
또한 Site Contract 완료 후 IRB Affairs 및 Site Contract 업무에 대해 CRA와 Over-sight 로 관리되고 있어 효율적인 관리 및 진행이 가능합니다.
Accelerated Site Start up
Site Start up은 임상 시험 중 가장 복잡하고 크게 규제되는 부분 중 하나입니다.
특히, 임상 시험에서는 변경이 불가피하지만 연구 시작 단계에서는 변경 사항이 전반적인 타임 라인 및 임상 시험 상당한 영향을 줄 수 있습니다.
이 기간에는 사이트, 규제 기관 (RA), 윤리위원회 (EC), vendor 및 sponsor 와 같이 상당수의 이해 관계자가 관련됩니다.
이러한 이유로 초기 계약, 명확한 의사 소통 및 효과적인 계획은 프로젝트 일정을 가속화하는 데 중요합니다.
DreamCIS SSU team 는 중요한 결과(산출)물을 면밀히 모니터링하고 이에 따라 프로세스의 우선 순위를 정합니다.
이후 사이트 관계를 활용하며 Site Contracts 팀과 협력하여 EC 또는 필수 규제 문서 프로세스가 해당 사이트의 승인을 조건으로 하는지 확인하여 이를 바탕으로 진행합니다.
이러한 방법은 가능한 한 신속하게 사이트를 시작하고 계획에 따라 등록 일정을 최대화 할 수 있는 드림씨아이에스만의 강점입니다.
Service Scope
Clinical Monitoring
About Service
임상시험 개시 방문, 정기 모니터링, 종료 방문 업무를 포함하여 임상시험 진행 중 전체적인 Site management 업무를 수행하고 있습니다.
DreamCIS의 CO(Clinical Operation) Division은 풍부한 과제 수행 경험이 있고 숙련된 전문 인력들로 프로젝트 팀을 구성하여 고객의 리스크와 비용을 절감하고 신뢰성 있는 데이터 결과를 바탕으로 한 최상의 임상시험 진행 서비스를 제공하고 있습니다.
숙련된 전문인력은 ICH-Guideline, KGCP, SOPs, Protocol 등 관련 규정에 의한 Monitoring을 실시함으로써 임상시험 업무가 적절하게 수행되고 있는지 검증하고 수집된 데이터의 완성도와 정확성을 높이기 위한 품질관리를 시행하고 있습니다.
또한 각 기관과 긴밀한 interaction을 통하여 임상시험 결과에 대한 정확한 품질을 보장합니다.
DreamCIS는 지속적인 교육을 제공하여 PM 및 CRA가 항상 새로운 규정 변경사항을 숙지하도록 하고 최신 상태의 규정을 이해하도록 합니다.
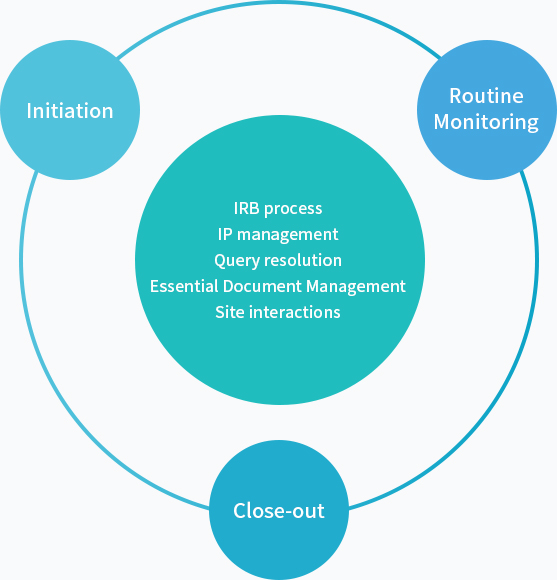
Service Scope
Overall management
In-house site management
On-site management
프로세스 소개
DreamtrialⓇ
About Service
DreamCIS가 제공하는 EDC 솔루션인 DreamTrial 은 오랜 기간 축척 된 Data Management 노하우를 바탕으로, 쉽고 빠르며 직관적으로 구현한 가장 신뢰할 수 있는 솔루션입니다.
쉽고 친숙한 웹 인터페이스를 제공하여 연구자가 쉽게 EDC를 사용할 수 있으며, 고객의 다양한 Needs를 적용할 수 있는 서비스를 제공합니다.
또한 EDC 시스템의 효율성을 극대화 하고 사용자에게 만족감을 제공합니다.
특히 임상시험 과제 특성에 많는 맞춤형 통계 정보 제공하며, 각종 보고서(AE , SAE , NSDR 등)를 실시간으로 자동 전달하여 Study 가 성공적으로 완료될 수 있도록 편의기능을 제공합니다.
드림씨아이에스의 DreamTrial 은 2013년부터 서비스를 시작하여, 현재까지 약 120 개의 과제를 수행하여, 5,461개 사이트의 8,584 명의 연구자가 사용을 하고 있습니다.
EDC 시스템을 통한 피험자 수는 220,582 명이며 한 개 과제 최대 23,000여 명의 대규모 피험자 연구가 진행되기도 하였습니다.
과제유형별로 Clinical Trail 은 23개 과제, NIS 13개 과제, rPMS 86개 과제를 수행하고 있으며, 글로벌 제약사가 52%, 국내로컬 제약사가 48% 를 이용하고 있습니다.
드림씨아이에스 EDC 시스템을 통해 다양한 질환의 연구가 진행되었으며 다수의 Audit 이나 Assessment를 통해 안정성 및 프로세스를 확립하였습니다.
Service Scope
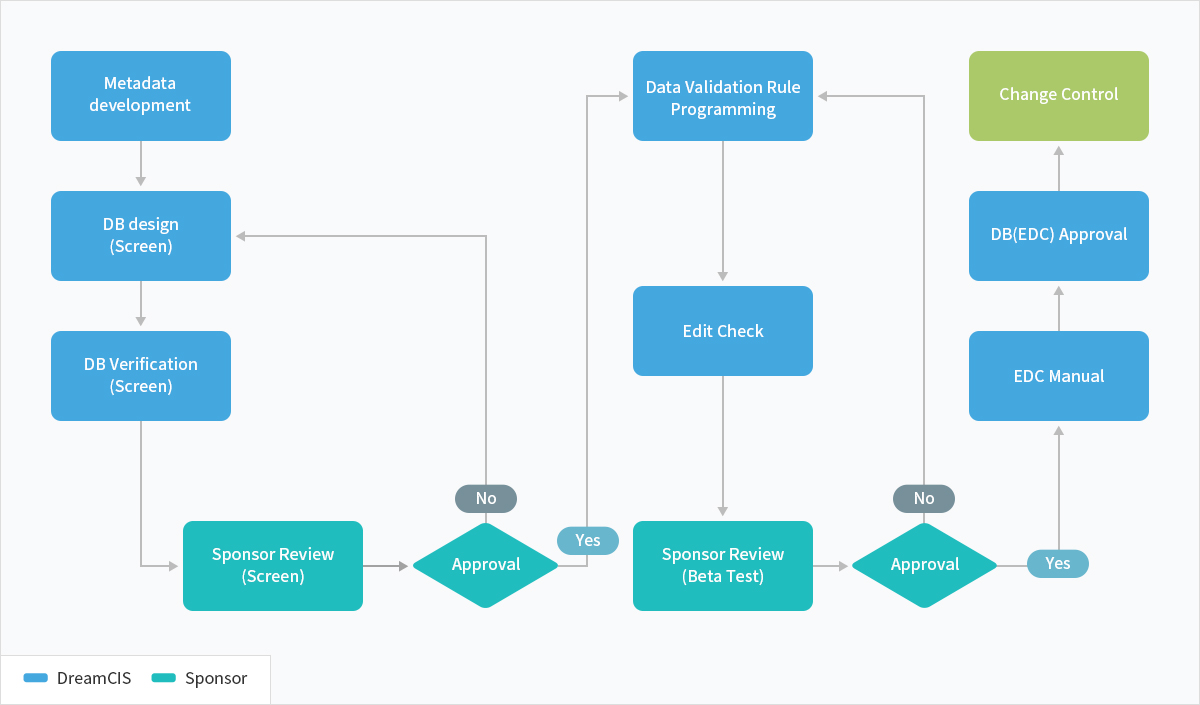
프로세스 소개
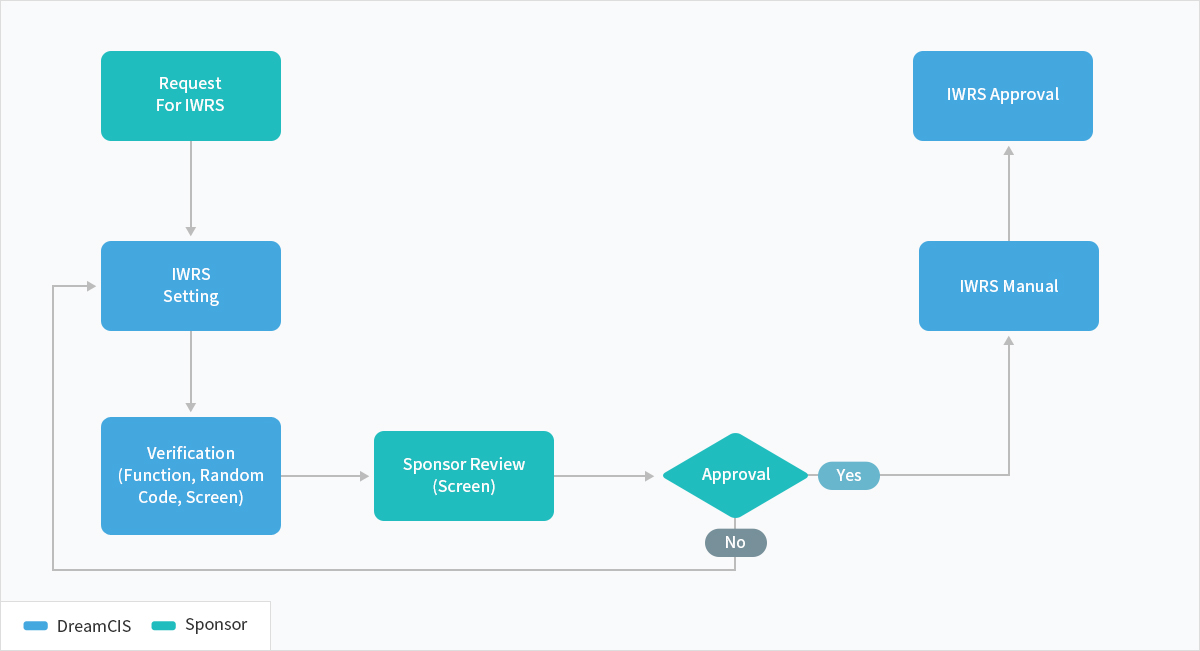
IWRS
About Service
DreamCIS에서 제공하는 IWRS 솔루션인 NewIWRS는 오랜 기간 축척 된 Clinical Trial 노하우를 바탕으로, 다양하고 복잡한 디자인의 Study를 쉽고 빠르게 구현할 수 있는 효율적인 솔루션입니다.
친숙한 웹인터페이스를 제공하며 다국어 지원으로 연구자가 쉽게 IWRS를 사용할 수 있습니다.
고객의 다양한 Needs를 적용하기 위해 기존 IWRS에서 제공하지 못했던 의약품 관리기능이 추가 되었습니다.
효율적인 의약품 관리와 시험대상자 관리 기능으로 사용자에게 만족감을 제공 합니다.
NewIWRS는 별도의 프로그래밍 지식이 없더라도 몇 가지 설정으로 빠른 Study의 셋업이 가능합니다.
자체 Randomization 엔진 제공으로 Randomization 코드를 쉽게 생성 할 수 있으며, 필요 할 경우 사용자가 원하는 외부 Randomization code를 사용 할 수 있습니다.
이러한 기능으로 개발 일정이 기존보다 단축되어 임상시험 진행 시 고객에게 신속한 서비스를 제공 할 수 있습니다.
Service Scope
프로세스 소개
Quality Assurance
About Service
Quality Assurance
DreamCIS QA는 의약품 생산부터 전 임상시험, 임상시험, 시판 후 조사, 의약품 운송까지의 전문적 지식과 경험을 기반으로, 규제기관 요구사항에 기반한 점검과 컨설팅 서비스가 가능합니다.
Quality management를 위한 기본 구조를 파악해 regulation의 현실적 실행 방법을 제안하며, 성공적인 프로젝트를 위한 Quality management 직접 수행부터 컨설팅 서비스까지 제공합니다.



